와이디생명과학은 임상개발제품인 YD-312의 당뇨성황반부종(DME)치료제 임상2a상 시험에서 유효한 치료 효과를 확인했다고 밝혔다. [사진=와이디생명과학 제공]
와이디생명과학은 임상개발제품인 YD-312의 당뇨성황반부종(DME)치료제 임상2a상 시험에서 유효한 치료 효과 확인과 함께 통계적으로도 유의한 결과를 얻었다고 13일 밝혔다.
회사 측은 인체에서의 YD-312 치료 효과와 안전성을 검증하기 위한 임상2a시험을 당뇨성황반부종 환자를 대상으로 한국과 미국에서 각각 승인을 받았다고 설명했다. 이어 2018년부터 글로벌 통합 임상시험을 진행하고 있다고 덧붙였다.
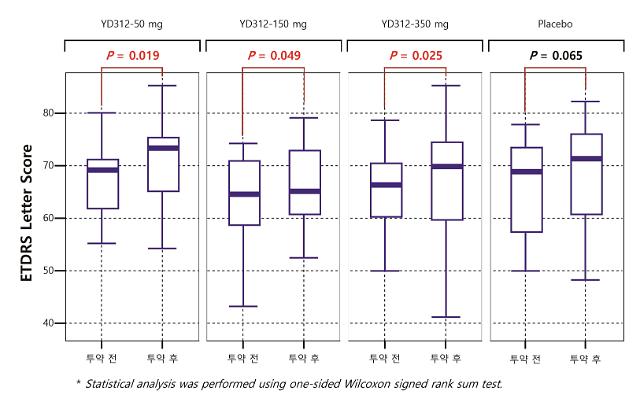
당뇨성황반부종은 당뇨병에 의해 유발되는 합병증으로, 망막혈관의 투과도가 비정상적으로 증가해 혈관 내부 물질이 흘러나와 망막 가운데 위치한 황반 조직이 부어오르며 중심시력 저하를 유발하고 실명까지 초래하는 질환이다. 임상2a시험은 당뇨성황반부종 환자를 대상으로 YD-312 저용량, 중간용량, 고용량군에 각각 경구로 12주 간 투약해 그 치료효과를 시험했다.
와이디생명과학 관계자는 “미국 임상시험기관(CRO)로부터 최종 수신한 임상결과보고서(CSR, Clinical Study Report)를 통해 모든 YD-312 용량 별 투약군에서 투약 후 시력이 투약 전과 비교해 통계적으로 유의한 개선효과가 확인됐다”며 “시력이 유지되거나 개선된 치료유효율이 위약군과 비교해 유의미하게 높은 것으로 나타났다”고 말했다.
이어 “임상시험 중 임상약과 직접적으로 관련된 부작용이나 이상 징후는 발견되지 않아, 안전성 측면에서도 이상이 없음을 확인했으며, 이러한 결과를 바탕으로 YD-312의 망막질환에 대한 치료효과와 안전성이 인체에서 확인됨으로써 추후 단계의 개발과정이 순조롭게 진행될 수 있는 계기가 마련됐다”고 밝혔다.
와이디생명과학은 YD-312의 다음 단계 개발로 당뇨성망막증(DR) 환자를 대상으로 하는 글로벌 임상2b시험을 준비하고 있다. 당뇨성망막증은 당뇨성황반부종과 연관성이 매우 높은 망막질환으로 망막혈관누출에 의해 노폐물이 망막으로 흘러나와 누적되어 비증식성 망막증이 유발된다. 이에 신생혈관생성이 동반되면서 증식성 망막증으로 발전한다.
회사 관계자는 “당뇨성망막증 유발에도 SCF/c-Kit이 중요하다는 점을 전임상시험을 통해 확인했고, 이를 바탕으로 적응증을 확대하여 후속 임상시험을 이어갈 수 있게 됐다“고 전했다.
당뇨성망막증은 당뇨성황반부종에 비해 최소 4배 이상의 환자군이 있고, 이 중 70% 이상이 비증식성 당뇨성 망막증 환자로 알려져 있다. 따라서 당뇨성 황반부종에 비해 더 큰 치료제 시장을 목표로 하게 된다는 점과 피험자 모집을 빠른 시간에 진행할 수 있다는 점이 비증식성 당뇨성망막증을 대상으로 임상2b시험을 계획하게 된 중요한 이유라고 회사 측은 설명했다.
이진우 와이디생명과학 대표는 “최근 코로나19 확산으로 인해 미국에서 최종 임상결과보고서 작성이 지연돼 기업공개(IPO) 일정을 철회하는 아픔도 있었지만, 결국 고무적인 임상결과를 발표하게 되어 매우 기쁘다. 앞으로 후기 임상시험을 더욱 성공적으로 진행해서 글로벌 신약개발의 꿈을 반드시 실현하겠다”고 강조했다.
이어 “이번 성공적인 임상시험 결과를 바탕으로 빅 파마와의 기술수출(Licensing Out) 논의도 급물살을 탈 수 있게 됐다. 현재 글로벌 제약사들로부터 지속적으로 임상시험보고서에 대한 요청과 검토가 이어지고 있어, 빠른 시일 내 매우 긍정적인 결과를 기대하고 있다”고 밝혔다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



