정부는 이날 코로나19 치료제‧백신 개발 범정부지원위원회(이하 범정부지원위원회) 5번째 회의를 개최하고, 국내·외 개발 동향 및 지원대책 추진현황, 코로나19 치료제·백신 임상시험 지원 계획, 코로나19 백신 도입 및 예방 접종 전략 등을 논의했다.
회의를 통해 범정부지원위원회는 코로나19 치료제·백신 임상시험 지원 대상으로 총 8개 과제(치료제 5개, 백신 3개)를 (예비)선정해 지원키로 했다. 기업의 임상시험 비용 부담 등 어려움을 완화하고, 임상시험 기간을 최대한 단축하기 위한 취지다.
8개 과제는 최종 개발 가능성과 포트폴리오 구성상 기술의 전략적 가치, 식품의약품안전처 임상시험계획(IND) 승인, 기업 과거 실적 등을 바탕으로 선정됐다.
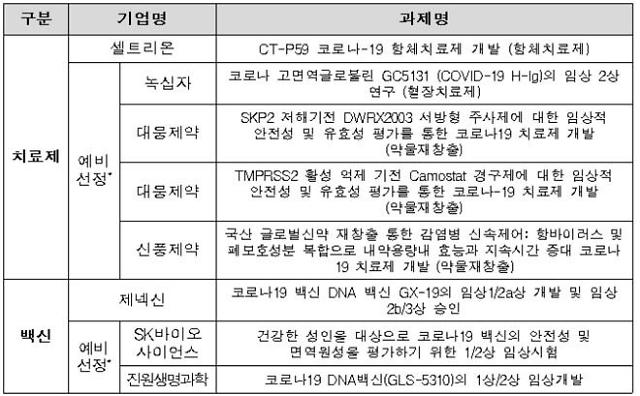
지원 대상 기업 현황 [자료=범정부지원위원회 제공]
정부는 이번에 선정된 과제 이외에도 신규로 유망한 과제를 지속적으로 발굴하기 위해 격월로 신규 과제를 선정·지원할 계획이다.
또 국내 확진자 감소 및 중증 환자 부족 등으로 임상시험에 어려움을 겪는 기업을 지원하기 위해 임상시험 수행이 가능한 거점병원과 환자 확보가 용이한 감염병 전담병원간 컨소시엄으로 구성된 ‘국가 감염병 임상시험센터’를 운영키로 했다. 지난 19일 3개 컨소시엄을 최종으로 선정했으며, 예비선정공고 절차 등을 거쳐 8월 말 연구에 착수한다. 컨소시엄에는 5억원의 지원금이 제공된다.
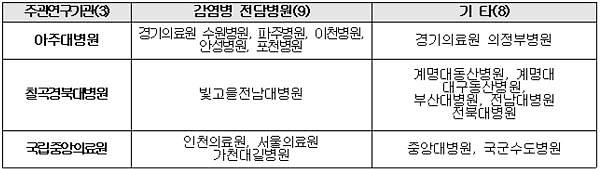
국가 감염병 임상시험 센터 컨소시엄 현황 [자료=범정부지원위원회 제공]
단기간 내 성과 창출을 위해 3차 추경을 통해 확보된 예산(1936억 원)도 약 83%를 집행하는 등 신속처리제(패스트트랙)를 적용하고 있으며, 기업의 애로사항에 대한 밀착 상담 및 상시·즉시 개선을 위해 범정부 차원의 협업 지원 체계도 가동하고 있다.
또 범정부지원단 산하에 ‘기업애로사항해소지원센터’를 설치해 개별 기업의 애로 사항을 상시 발굴·지원하고, 과학기술정보통신부, 중소벤처기업부, 식품의약품안전처 등 관계부처와 합동으로 심층상담을 실시하고 있다.
◆국내‧외 개발 동향 및 지원 현황
이날 회의에서는 치료제·백신 국내·외 개발동향에 대해서도 논의가 이뤄졌다.
치료제의 경우 약물 재창출 연구가 활발하게 진행되는 가운데, 혈장 치료제 및 항체 치료제 개발도 추진되고 있다.
혈장치료제는 국립보건연구원과 GC녹십자가 공동으로 개발을 진행 중이다. 식약처는 해당 혈장치료제의 임상2상을 지난 20일 승인했다.
항체치료제의 경우 국내에서는 국립보건연구원과 셀트리온이 협업으로 개발 중이며, 해외에서는 리제네론(임상 3상, 7.7), 일라이릴리(임상 3상, 8.3) 등이 임상시험을 개시했다.
백신의 경우 총 29종의 후보물질이 임상시험 중이며, 옥스퍼드대-아스트라제네카, 화이자-바이오앤텍, 모더나 등 6개 기업이 임상 3상에 진입한 것으로 알려졌다.
국내의 경우 제넥신(DNA 백신)이 1/2a상을 진행중(6.11 승인)이고, SK바이오사이언스(합성항원백신)와 진원생명과학(DNA백신)은 비(非) 임상시험 단계로 연내 3종이 임상 진입에 가능할 것으로 전망된다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



