화이자와 바이오엔테크가 공동 개발한 세계 첫 코로나19 백신이 영국과 미국 등을 중심으로 접종에 돌입했지만, 턱없이 모자란 공급량을 충당하기 위해서는 후속 백신의 출시가 절실하다. 모더나와 아스트라제네카 등 최소 2종의 백신이 내년 2월까진 출시할 수 있다는 관측이 우세한 가운데, 연내 접종 규모를 늘리기 위해 백신 출시·보급 속도를 더욱 높여야 한다는 목소리가 커지고 있다.
16일(현지시간) 영국 BBC는 아스트라제네카와 옥스퍼드대학이 개발 중인 코로나19 백신 후보 물질 'AZD1222'의 연내 출시 가능성이 '상당히 높다(pretty high)'고 보도했다.
BBC는 해당 백신의 개발 책임자인 사라 길버트 옥스퍼드대 교수를 인용해 아스트라제네카의 백신은 "지난달 27일 백신 긴급승인신청(EUA) 이후 영국 의약품건강관리제품규제청(MHRA)의 평가 마지막 단계에 도달한 상태"라며 "이미 1년 내내 MHRA의 롤링리뷰를 수행해왔다"고 설명했다.
롤링리뷰란 백신 승인과 상용화를 목표로 한 일종의 패스트트랙 제도로, 전체 임상시험 자료를 일괄적으로 제출해야 하는 통상적인 허가 신청 절차와 달리 완성된 부분부터 심사단위별로 단계적으로 제출해 심사받도록 한 사전검토 방식이다.
앞서 3상 임상 결과 아스트라제네카 백신의 평균 감염 예방 효과가 62%로 나타났다. 이는 아스트라제네카보다 먼저 출시 단계에 도달한 '메신저 리보핵산'(mRNA·전령RNA) 방식인 화이자나 모더나 백신이 보인 90~95%의 예방 효과에 못 미친다는 비판을 받기도 했다.
이와 관련해 BBC는 "62%가 상대적으로 낮은 수치더라도 약 50%의 예방률을 보이는 독감 백신보다는 높은 결과"라면서 "무엇보다도 백신을 맞을 경우 코로나19로 인한 입원이나 중증 증상을 피할 수 있다"고 지적했다.
이와 함께 아스트라제네카 백신은 모든 연령층에서 면역 효과가 나타나는 것으로도 확인했다.
55세 미만 접종군에서는 확실한 효과가 증명됐으며, 그 이상의 고령층은 상대적으로 낮아도 접종을 권장할 수 있는 수준이다. 이는 55세 이상 고령층을 대상으로 한 임상시험이 뒤늦게 추가되면서 결과 수치에 다소 차이가 난 것으로 알려졌다.
다만, 옥스퍼드대와 아스트라제네카는 앞서 3상 임상 결과 발표 당시 문제가 됐던 접종량에 따른 면역 효과 차이 문제는 여전히 충분한 해명을 내놓지 못했다.
지난달 23일 발표 내용에 따르면, 전체 2만3000명의 참가자 중 2741명이 총 2회 접종 중 최초 접종 과정에서 애초 계획한 용량의 절반밖에 투약받지 못했는데, 적정 용량을 투약한 집단(8895명·62%)보다 더 높은 90%의 감염 예방률을 보였다.
이와 관련해 BBC는 "과학자들은 백신 효과가 점진적으로 고조하는 것(primed gradually)으로 추정하고 있다"면서 이 때문에 영국 의약당국은 아스트라제네카 백신을 승인하면서 효과가 더 높았던 방식을 고심 중이라고 전했다.
MHRA가 최초 승인 시에는 당초 설계한 2회 전체 용량 접종을 허용한 후 임상 결과가 더 축적하는 대로 '1회 절반 용량 투약 후 2회차에서 전체 용량을 접종하는 방식'을 승인할 수도 있다는 것이다.

아스트라제네카 백신의 미국 출시 일정은 미국 식품의약국(FDA)의 요청에 따라 추가 임상시험에 돌입한 이유로 당초 내년 1월 말에서 3월 말까지로 미뤄질 것으로 보인다.
미국국립보건원(NIH) 임상시험정보사이트 '클리니컬트라이얼즈(clinicaltrials.gov)'에 따르면, 아스트라제네카가 개발 중인 코로나19 백신 물질 'AZD1222'의 미국 내 3상 임상 완료 예상일은 내년 2월 21일이며 FDA의 EUA 신청 가능일은 내년 3월23일로 예상된다.
지난 12일 파스칼 소리오 아스트라제네카 최고경영자(CEO)는 6주 안에 미국 FDA에 EUA를 신청하겠다고 밝히기도 했다. 아스트라제네카 측은 미국 당국이 미국 제약사 모더나와 화이자와 달리 유독 자사 백신에 까다로운 잣대를 들이댄다고 불평하기도 했다.
반면, 영국과 인도 등에서의 출시 일정은 상당히 임박한 상태다.
개발진인 길버트 교수뿐 아니라 영국 정부 최고의학보좌관인 크리스 휘티 역시 16일 기자회견을 통해 "MHRA는 외부 압력 없이 과학적 평가를 통해 늦어도 1월 초 혹은 그보다 빨리 아스트라제네카 백신 승인 여부를 결정할 것"이라고 밝혔다.
인도에서도 아스트라제네카 백신은 출시 승인 절차에 들어갔다. 아스트제네카는 세계에서 가장 큰 백신 생산 능력을 보유한 인도 세럼연구소(SII)와 해당 백신의 생산 제휴를 맺었으며, SII는 지난 7일 인도 약물관리국(DCGI)에 EUA를 신청했다.
앞서 지난달 28일 나렌드라 모디 총리는 SII을 방문하기도 했으며, 당시 백신 조기 승인과 배포·접종을 적극적으로 돕겠다는 약속을 하기도 했다. 당시 SII 측은 이미 4000만회분(2000만명분)의 백신을 생산해 비축해뒀으며, 현재 월 5000만∼6000만회분, 내년 1월 이후에는 월 1억회 분량의 백신을 생산 가능하다고 밝혔다.
브라질 역시 정부 차원에서 아스트라제네카 백신의 조기 도입을 추진 중이며, WHO 역시 EUA와 유사한 제도인 응급사용제품(EUL)에 화이자, 모더나, 아스트라제네카의 코로나19 백신을 '수 주 내' 등재하겠다고 밝히기도 했다.
EUL은 의약당국이 없어 백신이나 의약품의 사용 평가가 불가능한 국가들을 위해 대신 WHO가 평가해주는 제도로, 해당 목록에 등재할 경우 각국 정부는 이를 근거로 자국에서 해당 의약품에 대한 사용 허가를 내릴 수 있다.
특히, 아스트라제네카 백신은 전통 방식의 '바이러스 벡터(전달체)' 방식이라 생산이 쉽다는 점과 상온에서도 유통과 보관이 가능하다는 점은 최대 장점으로 꼽힌다.
아스트라제네카는 이를 적극적으로 활용해 이미 세계 최대 백신 생산시설인 인도의 SII를 비롯한 각국 현지 업체들과 생산 제휴 계약을 맺어놨다. 이에 따라 회사는 백신 사용 승인만 떨어진다면 당장 다음 달에도 전세계에 수억개의 백신을 공급할 수 있다고 장담하고 있다.
아스트라제네카는 내년 중 전 세계에서 백신 30억회 접종을 목표로 하고 있다. 이미 아스트라제네카는 영국 정부로부터 백신 1억회분을 사전 주문받았고, SII를 통해서는 인도 사용분 20억회분과 저소득·중위 소득 국가에 공급할 백신 10억회분을 생산할 예정이다. 이 외에도 브라질에선 1억회분, 인도네시아에선 4000만회분 등을 생산한다.
아스트라제네카 백신은 영상 2~8도의 일반 냉장고 온도에서 최소 6개월간 운송·보관·관리할 수 있는 점도 백신 보급을 높이는 데 좋은 조건이다.
mRNA 방식의 화이자와 모더나 백신은 각각 영하 70도와 영하 20도에서 보관을 원칙으로 하기에 유통과 관리가 까다롭다. 아스트라제네카 백신의 권장 온도인 영상 2∼8도에선 각각 5일과 30일 동안만 백신 효능 변화 없이 보관이 가능하다.
실제 지난 14일 화이자 백신의 접종을 시작한 미국에선 운송 과정에서 원인 불명의 이유로 보관 상자의 온도가 영하 92도까지 떨어져 16일 수천회분의 백신을 반납하기도 했다. 미국은 한 주간 290만회 분량의 화이자 백신을 공급받았다.

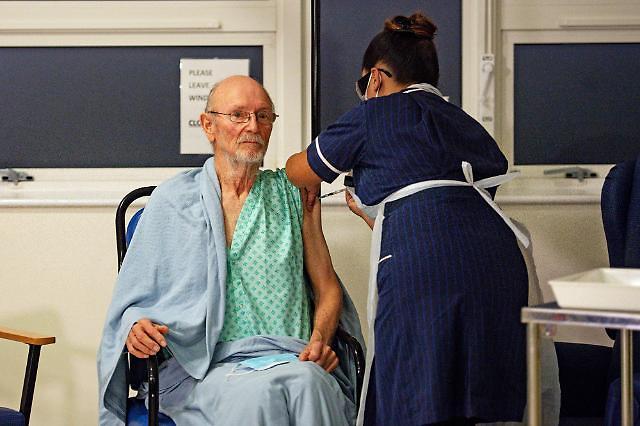
지난 8일(현지시간) 영국에서 세계 첫 코로나19 백신 접종을 시작한 가운데, 세계에서 2번째로 화이자바이오엔테크가 개발한 백신을 접종한 81세 윌리엄 셰익스피어.[사진=로이터·연합뉴스]
'62% 효과' 백신 성능 충분..."예방률 50% 독감 백신 감안시 효과 뛰어나"
16일(현지시간) 영국 BBC는 아스트라제네카와 옥스퍼드대학이 개발 중인 코로나19 백신 후보 물질 'AZD1222'의 연내 출시 가능성이 '상당히 높다(pretty high)'고 보도했다.
BBC는 해당 백신의 개발 책임자인 사라 길버트 옥스퍼드대 교수를 인용해 아스트라제네카의 백신은 "지난달 27일 백신 긴급승인신청(EUA) 이후 영국 의약품건강관리제품규제청(MHRA)의 평가 마지막 단계에 도달한 상태"라며 "이미 1년 내내 MHRA의 롤링리뷰를 수행해왔다"고 설명했다.
롤링리뷰란 백신 승인과 상용화를 목표로 한 일종의 패스트트랙 제도로, 전체 임상시험 자료를 일괄적으로 제출해야 하는 통상적인 허가 신청 절차와 달리 완성된 부분부터 심사단위별로 단계적으로 제출해 심사받도록 한 사전검토 방식이다.
이와 관련해 BBC는 "62%가 상대적으로 낮은 수치더라도 약 50%의 예방률을 보이는 독감 백신보다는 높은 결과"라면서 "무엇보다도 백신을 맞을 경우 코로나19로 인한 입원이나 중증 증상을 피할 수 있다"고 지적했다.
이와 함께 아스트라제네카 백신은 모든 연령층에서 면역 효과가 나타나는 것으로도 확인했다.
55세 미만 접종군에서는 확실한 효과가 증명됐으며, 그 이상의 고령층은 상대적으로 낮아도 접종을 권장할 수 있는 수준이다. 이는 55세 이상 고령층을 대상으로 한 임상시험이 뒤늦게 추가되면서 결과 수치에 다소 차이가 난 것으로 알려졌다.
다만, 옥스퍼드대와 아스트라제네카는 앞서 3상 임상 결과 발표 당시 문제가 됐던 접종량에 따른 면역 효과 차이 문제는 여전히 충분한 해명을 내놓지 못했다.
지난달 23일 발표 내용에 따르면, 전체 2만3000명의 참가자 중 2741명이 총 2회 접종 중 최초 접종 과정에서 애초 계획한 용량의 절반밖에 투약받지 못했는데, 적정 용량을 투약한 집단(8895명·62%)보다 더 높은 90%의 감염 예방률을 보였다.
이와 관련해 BBC는 "과학자들은 백신 효과가 점진적으로 고조하는 것(primed gradually)으로 추정하고 있다"면서 이 때문에 영국 의약당국은 아스트라제네카 백신을 승인하면서 효과가 더 높았던 방식을 고심 중이라고 전했다.
MHRA가 최초 승인 시에는 당초 설계한 2회 전체 용량 접종을 허용한 후 임상 결과가 더 축적하는 대로 '1회 절반 용량 투약 후 2회차에서 전체 용량을 접종하는 방식'을 승인할 수도 있다는 것이다.

아스트라제네카 백신의 개발 책임자인 사라 길버트 옥스퍼드대 교수.[사진=영국 옥스퍼드대학]
英·印서 승인 초읽기...막대한 생산 물량·상온 유통은 최대 장점
아스트라제네카 백신의 미국 출시 일정은 미국 식품의약국(FDA)의 요청에 따라 추가 임상시험에 돌입한 이유로 당초 내년 1월 말에서 3월 말까지로 미뤄질 것으로 보인다.
미국국립보건원(NIH) 임상시험정보사이트 '클리니컬트라이얼즈(clinicaltrials.gov)'에 따르면, 아스트라제네카가 개발 중인 코로나19 백신 물질 'AZD1222'의 미국 내 3상 임상 완료 예상일은 내년 2월 21일이며 FDA의 EUA 신청 가능일은 내년 3월23일로 예상된다.
지난 12일 파스칼 소리오 아스트라제네카 최고경영자(CEO)는 6주 안에 미국 FDA에 EUA를 신청하겠다고 밝히기도 했다. 아스트라제네카 측은 미국 당국이 미국 제약사 모더나와 화이자와 달리 유독 자사 백신에 까다로운 잣대를 들이댄다고 불평하기도 했다.
반면, 영국과 인도 등에서의 출시 일정은 상당히 임박한 상태다.
개발진인 길버트 교수뿐 아니라 영국 정부 최고의학보좌관인 크리스 휘티 역시 16일 기자회견을 통해 "MHRA는 외부 압력 없이 과학적 평가를 통해 늦어도 1월 초 혹은 그보다 빨리 아스트라제네카 백신 승인 여부를 결정할 것"이라고 밝혔다.
인도에서도 아스트라제네카 백신은 출시 승인 절차에 들어갔다. 아스트제네카는 세계에서 가장 큰 백신 생산 능력을 보유한 인도 세럼연구소(SII)와 해당 백신의 생산 제휴를 맺었으며, SII는 지난 7일 인도 약물관리국(DCGI)에 EUA를 신청했다.
앞서 지난달 28일 나렌드라 모디 총리는 SII을 방문하기도 했으며, 당시 백신 조기 승인과 배포·접종을 적극적으로 돕겠다는 약속을 하기도 했다. 당시 SII 측은 이미 4000만회분(2000만명분)의 백신을 생산해 비축해뒀으며, 현재 월 5000만∼6000만회분, 내년 1월 이후에는 월 1억회 분량의 백신을 생산 가능하다고 밝혔다.
브라질 역시 정부 차원에서 아스트라제네카 백신의 조기 도입을 추진 중이며, WHO 역시 EUA와 유사한 제도인 응급사용제품(EUL)에 화이자, 모더나, 아스트라제네카의 코로나19 백신을 '수 주 내' 등재하겠다고 밝히기도 했다.
EUL은 의약당국이 없어 백신이나 의약품의 사용 평가가 불가능한 국가들을 위해 대신 WHO가 평가해주는 제도로, 해당 목록에 등재할 경우 각국 정부는 이를 근거로 자국에서 해당 의약품에 대한 사용 허가를 내릴 수 있다.
특히, 아스트라제네카 백신은 전통 방식의 '바이러스 벡터(전달체)' 방식이라 생산이 쉽다는 점과 상온에서도 유통과 보관이 가능하다는 점은 최대 장점으로 꼽힌다.
아스트라제네카는 이를 적극적으로 활용해 이미 세계 최대 백신 생산시설인 인도의 SII를 비롯한 각국 현지 업체들과 생산 제휴 계약을 맺어놨다. 이에 따라 회사는 백신 사용 승인만 떨어진다면 당장 다음 달에도 전세계에 수억개의 백신을 공급할 수 있다고 장담하고 있다.
아스트라제네카는 내년 중 전 세계에서 백신 30억회 접종을 목표로 하고 있다. 이미 아스트라제네카는 영국 정부로부터 백신 1억회분을 사전 주문받았고, SII를 통해서는 인도 사용분 20억회분과 저소득·중위 소득 국가에 공급할 백신 10억회분을 생산할 예정이다. 이 외에도 브라질에선 1억회분, 인도네시아에선 4000만회분 등을 생산한다.
아스트라제네카 백신은 영상 2~8도의 일반 냉장고 온도에서 최소 6개월간 운송·보관·관리할 수 있는 점도 백신 보급을 높이는 데 좋은 조건이다.
mRNA 방식의 화이자와 모더나 백신은 각각 영하 70도와 영하 20도에서 보관을 원칙으로 하기에 유통과 관리가 까다롭다. 아스트라제네카 백신의 권장 온도인 영상 2∼8도에선 각각 5일과 30일 동안만 백신 효능 변화 없이 보관이 가능하다.
실제 지난 14일 화이자 백신의 접종을 시작한 미국에선 운송 과정에서 원인 불명의 이유로 보관 상자의 온도가 영하 92도까지 떨어져 16일 수천회분의 백신을 반납하기도 했다. 미국은 한 주간 290만회 분량의 화이자 백신을 공급받았다.

아스트라제네카와 옥스퍼드대학이 공동개발한 코로나19 백신 후보 물질 'AZD1222'.[사진=EPA·연합뉴스]
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



