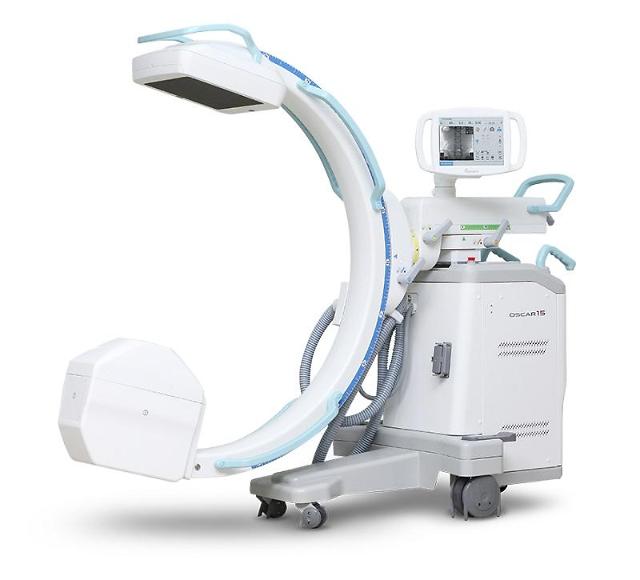
영상진단 의료기기 전문기업 제노레이는 기존 이동형 C-ARM(엑스선 투시 촬영장치)에 이어 디텍터 사양이 추가된 ‘OSCAR 15’, ‘OSCAR 15i’ 제품이 미국 식품의약국(FDA) 510(k) 승인을 받았다고 23일 전했다.
제노레이는 글로벌 의료용 영상진단장비 전문기업으로 연구·개발·판매·고객지원 전 과정을 수행한다. 특히 원천 핵심 기술과 제조 역량을 기반으로 미국, 유럽 등 80여 개국에 제품을 공급해 매출의 75% 이상을 수출에서 거두고 있는 기업이다.
FDA 510(k) 승인받은 ‘OSCAR 15’, ‘OSCAR 15i’는 이동형 C-arm 장비로 실시간 투시 동영상을 제공하며 정형외과, 신경외과, 마취통증의학과, 재활의학과, 비뇨기과, 혈관외과, 동물병원 등에서 폭넓게 사용하고 있다.
OSCAR 시리즈의 ‘OSCAR 15’는 대면적 3030 FPD(Flat Panel Detector) 기반의 최상급 사양이며, 'OSCAR 15i'는 I.I(Image Intensifier) 기반의 보급형 사양으로 구분됐다.
두 제품 모두 15kW급 고출력 X-ray 제너레이터가 탑재돼 체구가 큰 서양인 체형에 맞게 높은 품질로 영상을 촬영할 수 있다. 고출력 사양으로 최상급, 보급형을 아우르는 제품 라인업으로 미국 내 새 플랫폼을 정착시킬 예정이다.
제노레이 관계자는 "앞으로 현 상황에 안주하지 않고 글로벌 주요 국가에서 적극적인 허가 진행과 영업활동을 진행하며 업계 글로벌 리더로 도약할 것”이라고 전했다.
제노레이는 2001년도에 설립된 글로벌 기업으로 총 5개의 해외법인과 글로벌 45개 파트너를 통해 약 80개국에 제노레이 제품을 수출 중이다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



